(一)定义:
严重不良事件(Serious Adverse Event),简称SAE,是指医疗器械临床试验过程中发生的导致死亡或者健康状况严重恶化,包括致命的疾病或者伤害、身体结构或者身体功能的永久性缺陷、需住院治疗或者延长住院时间、需要采取医疗措施以避免对身体结构或者身体功能造成永久性缺陷;导致胎儿窘迫、胎儿死亡或者先天性异常、先天缺损等事件。
(二)报告范围:(除方案中有特殊规定,一般按以下范围报告)
1. 导致死亡;
2. 致命的疾病或者伤害;
3. 身体结构或者身体功能的永久性缺陷;
4. 需住院治疗或者延长住院时间;
5. 需要采取医疗措施以避免对身体结构或者身体功能造成永久性缺陷;
6. 导致胎儿窘迫、胎儿死亡或者先天性异常、先天缺损;
7. 其他。
(三)报告流程、部门及方式:
1. 本院安全性信息报告
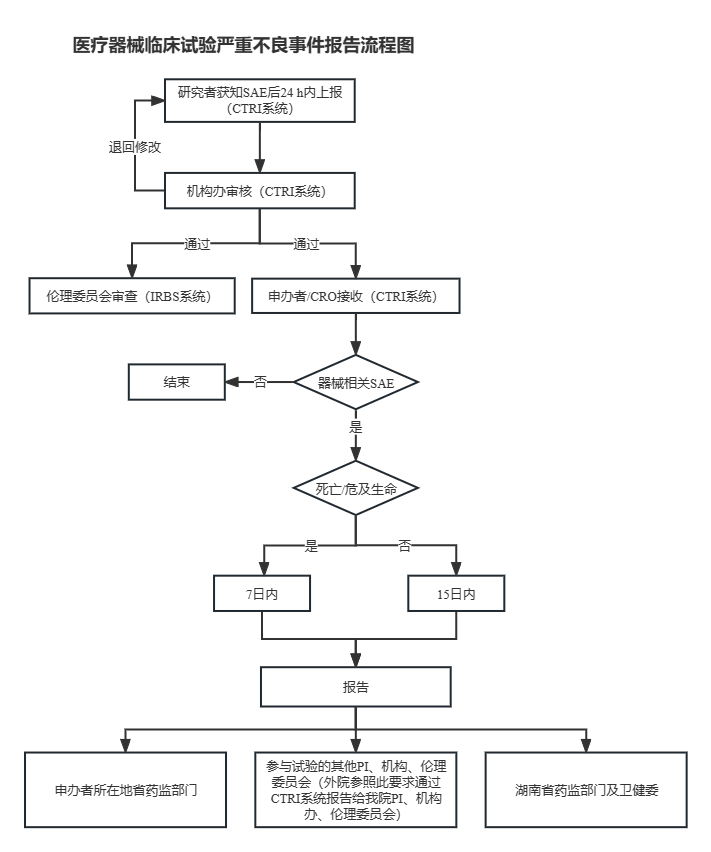
1)研究者上报:研究者在获知SAE后的24小时内通过临床研究电子记录及信息交互系统(CTRI)上报,并按照临床试验方案的规定随访SAE,提交SAE随访报告和总结报告。
2)机构办审核:机构办安全信息专员在CTRI系统中审核接收的SAE,审核未通过的报告将退回至上报研究者修改,审核通过的报告将流转至伦理委员会审查和申办者/CRO接收。
3)伦理委员会审查:伦理委员会通过伦理审查管理系统(IRBS)审查机构办安全信息专员审核通过的SAE。
4)申办者/CRO接收:申办者/CRO在CTRI系统中接收机构办审核通过的SAE等安全性相关信息,并对死亡或者危及生命的临床试验医疗器械相关严重不良事件7日内、对非死亡或者非危及生命的试验医疗器械相关严重不良事件和其他严重安全性风险信息15日内向其他医疗器械临床试验机构、主要研究者、伦理委员会报告,同时向申办者所在地省、自治区、直辖市药品监督管理部门报告,向湖南省药品监督管理部门和卫生健康管理部门报告。
2. 外院安全性信息报告
申办者/CRO收到外院安全性信息后,应当在获知死亡或者危及生命的临床试验医疗器械相关严重不良事件后7日内、获知非死亡或者非危及生命的试验医疗器械相关严重不良事件和其他严重安全性风险信息15日内通过CTRI系统上报。
(四)报告内容及要求:
1. 严重不良事件报告类型分为首次报告、随访报告、总结报告及其他报告,具体报告类型按照实际勾选或填写。
2. 详细处理情况除包含常规内容外,必须明确以下内容:
a)描述受试者参加医疗器械临床试验情况;
b)描述试验医疗器械使用情况,对有源和无源医疗器械应当描述器械具体操作使用情况,出现的非预期结果,(可能)对受试者造成的伤害,采取的救治措施以及结果等。对体外诊断医疗器械,应当描述受试者诊疗信息(如疾病情况、用药情况等)、样本检测过程与结果、发现的异常情况、采取的措施、最终结果判定、对临床诊疗的影响等;
c)描述严重不良事件发生与处理情况;
d)事件与关系的判定依据。
3. 研究者应按照受试者发生的不良事件的具体情况和既往病史、伴随疾病情况以及伴随用药等情况进行综合分析,判断事件与医疗器械的关系。判断原则为:
a)与试验医疗器械有关:(1)两者存在合理时间关系;(2)试验器械已知风险或者可以用试验器械的机理去解释;(3)停止使用后伤害减轻或消失;(4)再次使用后伤害再次出现;(5)无法用其他影响因素解释。同时满足其中五条判断为“肯定有关”,满足其中两条判断为“可能有关”;
b)与试验医疗器械无关:(1)两者不存在合理时间关系;(2)该不良事件为该试验医疗器械不可能导致的事件类型;(3)该不良事件可用合并用械/药、受试者病情进展、其他治疗影响来解释。同时满足三条判断为“肯定无关”,满足其中一条判断为“可能无关”。
4. 追踪随访:一经判断事件为SAE,研究者必须随访该事件直至出现好转、稳定。
5. 当出现研究方案中规定SAE与研究终点的确定需要第三方裁定的情况,应在按照研究方案中规定的流程,进行相关裁定的同时进行SAE的报告;如裁定结果不为SAE,研究者应在获知裁定结果的24小时内参照相关要求进行SAE的撤销或者修正报告。
6. 一般情况,SAE发生时间默认为导致该事件的具体日期(可以与AE不为同一天)。如遇以下情况,需作出合理解释后进行报告:
a) 研究方案中明确列出不属于SAE范畴,需撤回;
b) 修改与研究器械相关性;
c) 修改SAE医学术语诊断;
d) 修改报告类型等上述未提及的表格内其他内容的。
7. 如遇同一受试者在发生SAE期间内病情恶化或者出现导致其他后果的SAE,研究者应按照情节最为严重的后果进行报告。