
适用范围:
我院开展的非注册类临床研究均按照研究者发起的临床研究(IIT研究)管理,应按照以下流程开展科学性审查。
操作流程:
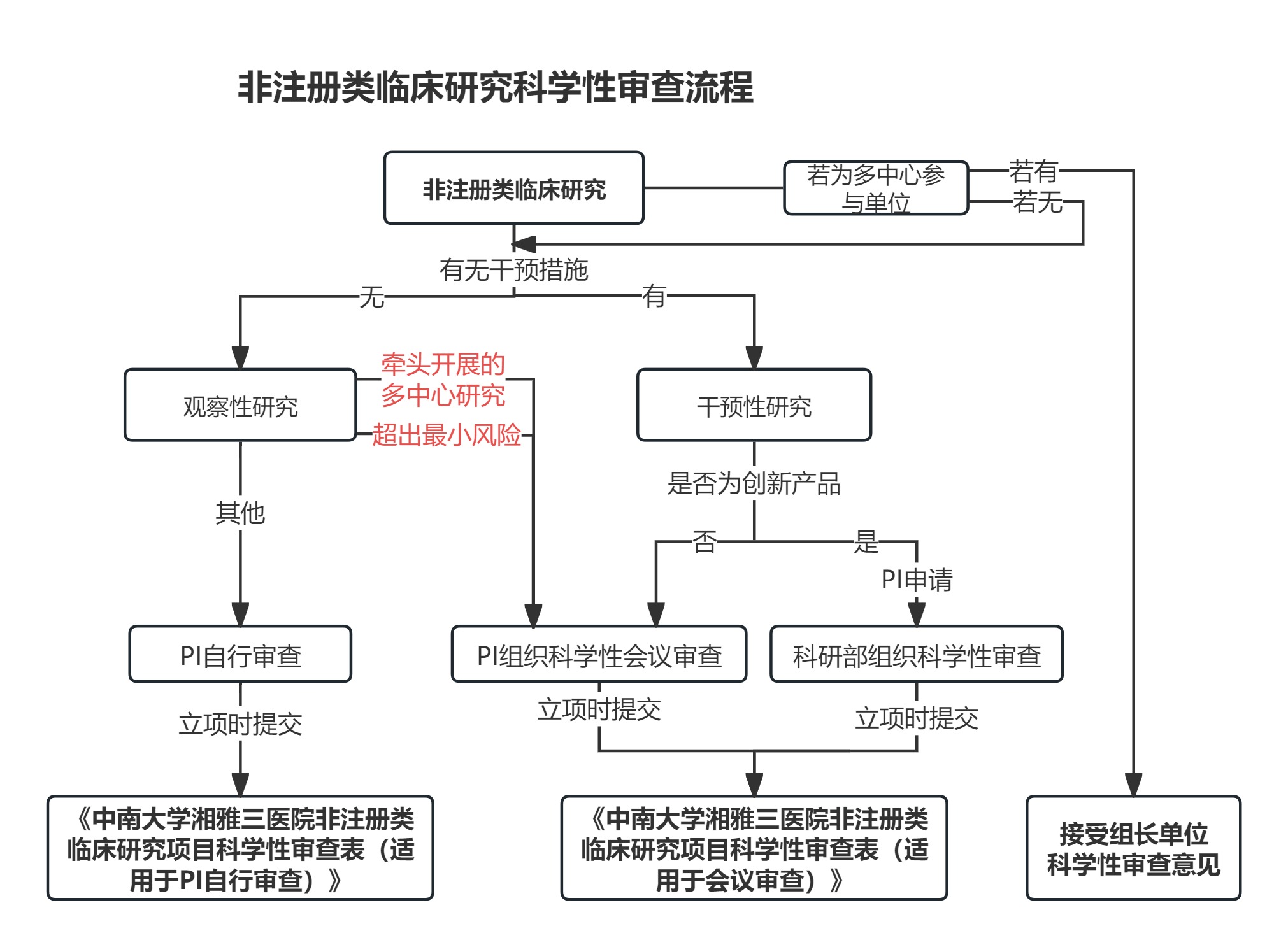
1. 主要研究者(PI)发起的临床研究均应进行科学性审查,应对临床研究的科学性、伦理合规性负责,并向伦理委员会和机构办公室提交科学性审查意见。
2. 不同研究类型,科学性审查方式如下:
2.1 观察性研究,PI可自行审查或组织会议审查,立项时提交《中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于PI自行审查)》(附件1)或《中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于会议审查)》(附件2))。
2.2 干预性临床研究、牵头开展的多中心观察性研究或者超出最小风险的观察性研究,PI应组织会议审查,立项时提交《中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于会议审查)》(附件2)。
2.3 对于创新产品等高风险的临床研究,应由PI提出申请,填写《科学性审查申请表》(附件3),由科研部组织科学性审查,立项时提交《中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于会议审查)》(附件2)。
3. 科学性审查内容应包括研究的合理性、必要性、可行性,以及研究目的、研究假设、研究方法、干预措施、研究终点、研究安全性、样本量等。
4. 科学性审查的专家应覆盖临床研究所属专业领域和研究方法学领域,一般不少于3人(不含PI)。干预性研究的科学性审查一般应当有本医疗卫生机构外专家参加。其他要求请详见附表备注。
5. 项目经科学性审查后,应提供《中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于PI自行审查)》或《中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于会议审查)》;对于我院参与的多中心IIT研究,项目组也可以提供牵头机构科学性审查论证意见。
6. 在研究过程中如主要研究者对已立项的临床研究项目进行变更的,应当向伦理委员会报告,对于有实质修改的,应当重新进行科学性审查,在伦理审查时递交科学性审查表。
7. 伦理委员会通过后,主要研究者登录国家医学研究登记备案系统进行备案,并上传科学性审查意见文件和伦理委员会批件。
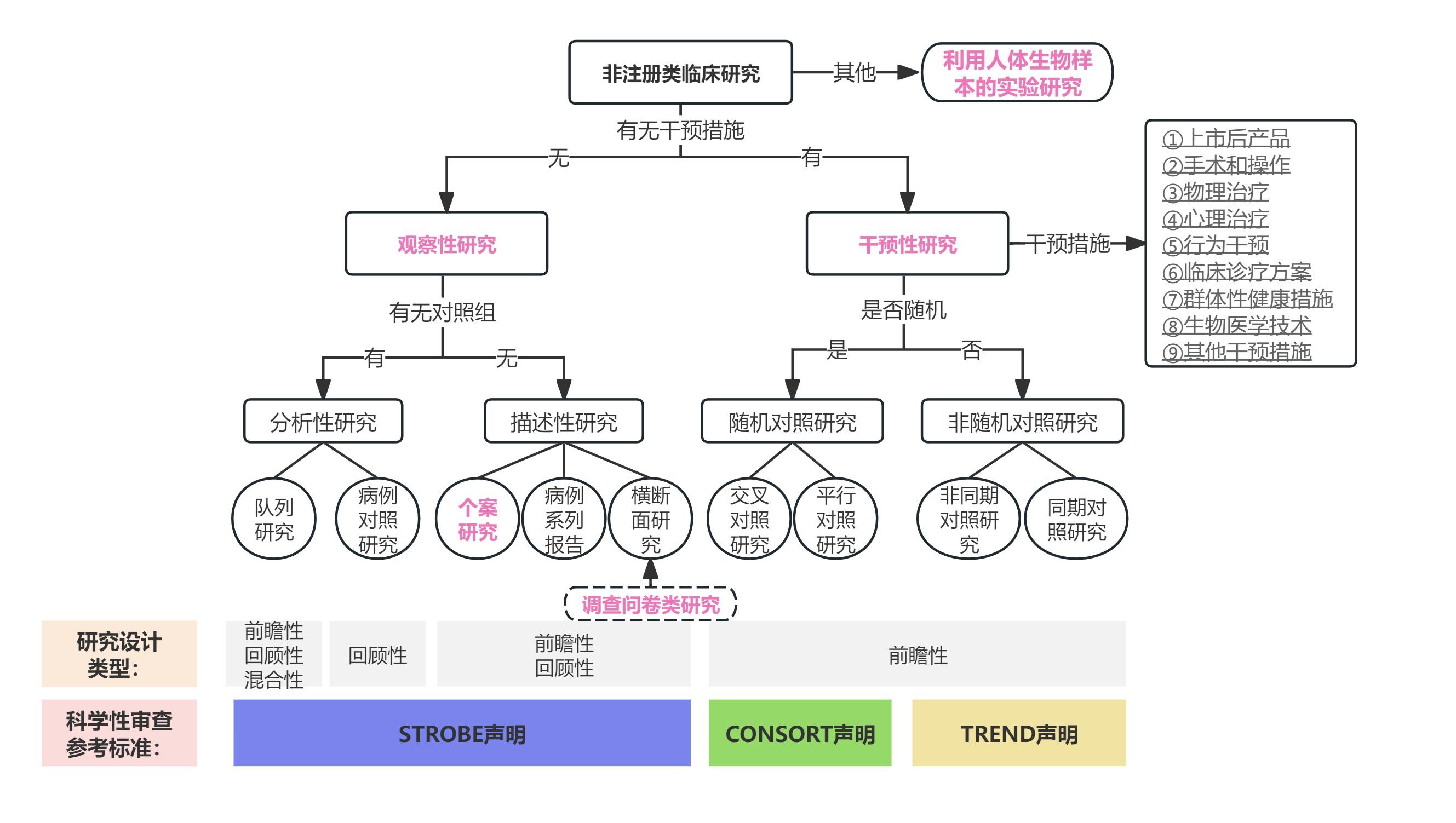
非注册类临床研究分类图:
非注册类临床研究科学性审查流程图:
附件1:![]() 中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于PI自行审查) -1.1版-2025年4月24日
中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于PI自行审查) -1.1版-2025年4月24日
附件2:![]() 中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于会议审查)-1.2版- 2025年4月14日
中南大学湘雅三医院非注册类临床研究项目科学性审查表(适用于会议审查)-1.2版- 2025年4月14日
附件3:![]() 科学性审查申请表
科学性审查申请表