
1、用户注册:由申办者/CRO委派的CRA提出申请。CRA登录我院临床研究电子记录及信息交互系统(简称CTRI系统,网址https://ctri-xy3.ghcchina.cn)注册账号,建议使用谷歌浏览器,注册时请确保手机号填写准确。注册提交后,管理员审核通过注册成功。
2. 2、CRA备案:CRA登录CTRI系统,未备案的CRA首次意向申请需先进行备案,备案完成后方可在系统中进行意向申请。
3. 3、意向申请:CRA点击“意向申请”,按要求填写项目相关信息后提交审查,机构办公室主任进行意向审核,与专业沟通确认承接后分配主要研究者,完成意向申请。
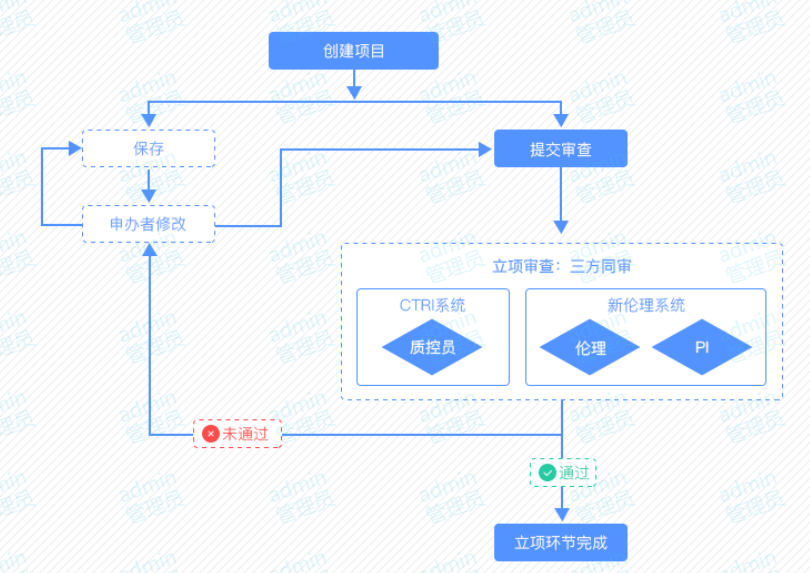
4. 4、创建项目:CRA登录CTRI系统创建项目,填写临床试验立项申请表,并上传电子版申请材料(目录及文件详见附件一)。创建项目前请详细阅读CTRI系统文件上传注意事项(附件二),资料上传完成后提交审查。
5. 5、审核反馈:项目主要研究者、机构办公室、伦理办公室三方同步受理并审核,项目意见反馈给CRA后,CRA按照三方的意见进行补充或说明。
6. 6、立项完成:三方同审通过后,系统短信通知CRA立项完成,CRA可申请伦理审查及合同审核。
附件二:![]() CTRI系统文件上传注意事项
CTRI系统文件上传注意事项